《수학, 물리학, 화학, 생물학을 비롯한 기초과학을 발전시켜 그것이 나라의 과학기술을 발전시키는데 더 잘 이바지하도록 하여야 하겠습니다.》 (
아밀로이드단백질섬유는 개별적인 단백질들이 주로 베타면구조를 이루면서 서로 응집되여 생겨난다. 이러한 섬유의 형성은 알츠하이머병과 파킨손병과 같은 신경퇴행성질병들과 련관되여있다. 지난 수십년간 많은 실험적증거들은 섬유형성의 초기단계에 산생되는 올리고머들과 원섬유들이 사실상 아밀로이드단백질섬유보다 더 독성이 강하다는것을 보여주고있다. 아밀로이드단백질의 응집되는 초기단계에서의 물리화학적현상들을 정확히 리해하는것은 이러한 신경퇴행성질병들의 치료법을 찾는데 도움을 주게 될것이다.
아밀로이드단백질섬유의 안정성은 보통 베타면구조를 이루는 단백질들사이의 조밀한 수소결합에 의한것이라고 본다. 하지만 Aβ1-42섬유에 대한 최근의 고체상태핵자기공명분광실험결과는 아밀로이드단백질의 안정성에 곁사슬들사이의 강한 소수성호상작용에 의하여 형성된 소수성핵도 큰 역할을 한다는것을 보여주었다. 한편 이러한 소수성핵이 커질 때 올리고머의 독성이 더 증가한다는것을 보여주었다. 이러한 곁사슬들사이의 소수성호상작용과 기본사슬들사이의 친수성호상작용들의 정확한 결합물림새와 아밀로이드단백질의 응집과정에서 그의 정확한 역할은 아직도 밝혀지지 못하였다.
이러한 아밀로이드단백질의 응집물림새를 명백히 밝히자면 응집과정을 실시간적으로 관측하는것이 매우 중요하다. 이러한 관측수법들중의 하나가 빛을 리용하는것이며 따라서 아밀로이드단백질의 광학적성질을 연구하는데 많은 관심이 돌려지고있다. 최근의 실험연구들은 아밀로이드단백질섬유에서 고유형광이 나타난것을 보여주었다. 특히 아밀로이드단백질응집체들이 250~500nm파장대역의 빛을 흡수하는것으로 관찰되였다. 놀랍게도 이러한 특성은 방향족아미노산의 존재에 무관계하게 나타났다.
우에서 언급한 고유형광특성은 아밀로이드단백질에서만 나타나는 현상이 아니다. 알라닌과 발린, 이소로이신에 기반을 둔 비방향족단백질들의 응집상태에서도 고유형광이 나타났으며 이것은 고유형광이 아미드결합들사이의 수소결합들과 관련되여있다는것을 보여준다. 최근 프라싸드와 그의 공동연구자들은 방향족곁사슬을 포함하지 않는 단백질단량체들에 대한 형광연구를 진행하는 과정에 그의 흡수스펙트르에서 파장 250~80nm대역에서 의미있는 흡수와 함께 대략 800nm정도의 긴 꼬리를 발견하였다. 그들은 이 단백질에 대한 전자구조계산들을 통하여 공간적으로 가까이 놓인 리진과 글루타민의 곁사슬들과 기본사슬들이 각각 빛에 의한 전하이동의 받개와 주개로써 작용한다는것을 보여주었다.인슐린이나 리조짐의 응집과정에서 나타나는 고유형광의 증가는 이러한 현상이 산화와 같은 화학작용에 의한것일수 있다는것을 암시해준다.
이 고유형광은 아밀로이드단백질과 류사한 응집체들의 구조적변화를 조사하는 실험수단으로써 리용될수 있다. 실례로 안싸리와 그의 공동연구자들은 사람의 c-Myc단백질의 PEST부분이나 그 변종들의 250~800nm대역에서의 흡수세기가 전하를 띤 기능단들의 3차원배치구조에 의존한다는것을 보여주었다. 더우기 3~11사이에서의 pH변화와 온도와 농도변화에 따르는 스펙트르의 변화는 단백질들의 2차구조와 형광사이의 강한 상관성을 보여준다. 전하이동에 의한 흡수스펙트르와 전하를 띤 원자단들의 공간구조사이의 관련성은 비방향족화합물들을 새로운 형광물질로 리용할수 있는 가능성을 준다.
연구에서는 아밀로이단백질섬유의 광학적성질에 미치는 끝부분원자들의 영향을 론의하기 위하여 형광스펙트르실험과 제1원리계산을 결합하였다. 모의실험에서는 우선 6개의 아미노산으로 이루어진 Aβ30-35 (2Y3J, AIIGLM)과 함께 Aβ1-42의 끝부분을 아세틸화한 펩티드도 고찰하였다.
지난 시기에도 아밀로이드단백질의 광학적성질을 리해하기 위한 리론 및 실험적연구들이 진행되였지만 광학적성질에 미치는 단백질구조변화의 영향을 고찰하지 못하였으며 더우기 GGA범함수리론을 리용한것으로 하여 계산의 정확도가 높지 못하다. 이 연구에서는 광학려기의 원인에 대한 보다 정확한 해석을 진행하기 위하여 GGA보다 정확한 혼성범함수를 리용하였다.
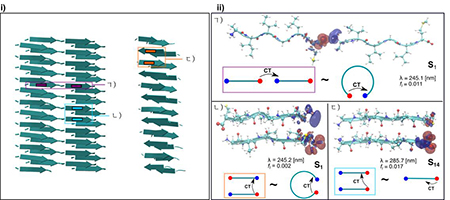
ⅰ)평형 및 비형형저급단섬유, ⅱ)각이한 결합상태를 가진 이량체들에서 바닥상태와 려기상태사이의 전하밀도차를 나타내는 등고면: ㄱ) 선형결합, ㄴ) 반평형, ㄷ) 평형: 붉은색과 푸른색은 각각 전자와 구멍의 변화를 나타내는 등고면
계산모의결과들은 실험적으로 얻어진 끝부분의 변화에 따르는 스펙트르에서의 변화가 수소결합세기에서의 변화이라는것을 보여준다. 또한 아밀로이드단백질의 저에네르기려기가 C끝부분과 N끝부분사이와 C끝부분과 단백질의 기본골격사이의 전하이동에 의한것이라는것을 보여준다.
따라서 아밀로이드단백질의 분광학적특성은 공간적인 구조뿐아니라 수소결합의 특성을 반영할수 있다는것을 알수 있다.
구체적인 내용은 SCI잡지 《Phys. Chem. Chem. Phys.》(2019,00,1-12)에 《Amyloid Aggregates and their Optical Properties》(https://doi.org/10.1039/c9cp04648h) 의 제목으로 출판되였다.